你知道吗?我们身体里藏着一支“信号通信队”:G蛋白偶联受体(GPCR),它们趴在细胞膜上,像哨兵一样接收激素、神经递质等信号,再通过细胞内的“传令兵”把指令传递到深处,调控着心跳、血糖、情绪等几乎所有生理过程。而在这支“通信队”里,有个关键“传令兵”叫环腺苷单磷酸(cAMP),它的浓度变化直接反映GPCR的工作状态,是判断药物是否有效的核心依据。 当前,对细胞内 cAMP 动态变化的精准检测是 GPCR 信号通路研究与药物研发的关键环节,而均相时间分辨荧光(HTRF)技术是实现该检测需求的核心技术手段。小编在这里系统阐述 HTRF 技术的检测原理与应用逻辑,分析其在 GPCR 药物研发中的技术价值与实践作用。
1
先搞懂:什么是 GPCR?
GPCR,全称“G 蛋白偶联受体”(G protein-coupled receptors),是存在于人体细胞表面的一类膜蛋白,就像细胞的“信号通信队”,能识别并结合体内的各类信号分子(比如激素、神经递质、脂质等),再通过与细胞内的G蛋白结合,将信号传递到细胞内部,进而调控生长、代谢、神经传递等关键生理过程。
从数量上看,GPCR 是人体最大的膜蛋白家族,约有 800 个成员[1]。不过其中近一半(约 400 个)是嗅觉受体,主要负责感知气味,不在药物研发的核心关注范围内;我们常说的 “药物研发相关 GPCR”,主要指剩下的400个左右“非嗅觉 GPCR”,它们广泛参与心血管、神经、代谢等系统的功能调节,也是疾病发生的重要“导火索”: 比如高血压、抑郁症、糖尿病等疾病,都可能与GPCR功能异常有关。
根据进化关系和结合的信号分子(配体)差异,GPCR 还能分成不同“家族”,配体种类从简单的离子、小分子(如shen上腺素),到复杂的肽类(如胰高血糖素样肽 GLP-1)、蛋白质都有,这种多样性也让它成为能覆盖多种疾病的“wan能靶点”基础。GPCR药物研发,就是针对这些关键的“通信兵”开发药物,通过调节它们的功能来治疗疾病的科学探索过程。
2
为什么cAMP是GPCR研发的“关键信号”?
G蛋白偶联受体(GPCR)是极其重要的药物靶点家族,而环磷腺苷(cAMP)作为GPCR下游最关键的第二信使之一,其浓度变化直接反映了受体的激活状态。
GPCR接到外界信号后,会“召唤”细胞内的G蛋白帮忙。G蛋白家族里有两个关键成员:Gαs和Gαi。它们对cAMP的影响完全相反:
当GPCR与Gαs结合,会激活一种叫“腺苷酸环化酶(AC)”的物质,AC就像个“加工厂”,能把ATP(细胞能量货币)转化成cAMP,让细胞内cAMP浓度升高;
要是GPCR结合的是Gαi,就会抑制AC的活性,“加工厂”停工,cAMP浓度自然下降。
而cAMP浓度的高或低,又会进一步调控离子通道、蛋白激酶A(PKA)等“下游执行者”,最终影响细胞功能。比如,调节血糖的GLP-1受体被激活后,cAMP升高会促进胰岛素分泌;治疗高血压的β受体被抑制时,cAMP降低能减缓心跳。
所以,精准测量cAMP浓度,就像给GPCR装了个“信号仪表盘”:药物是否能激活/抑制目标GPCR、效果有多强,看cAMP的变化就知道。
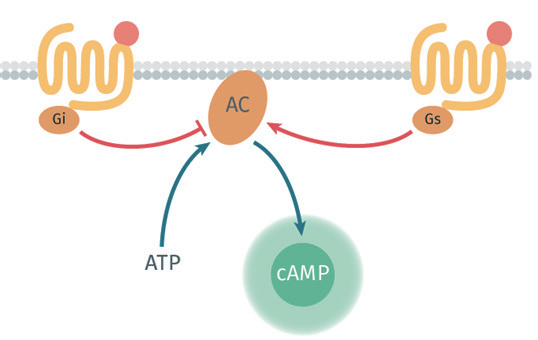
Gαs(激活)、Gαi(抑制)对cAMP水平的调控
3
HTRF技术:如何做到“精准捕捉”cAMP?
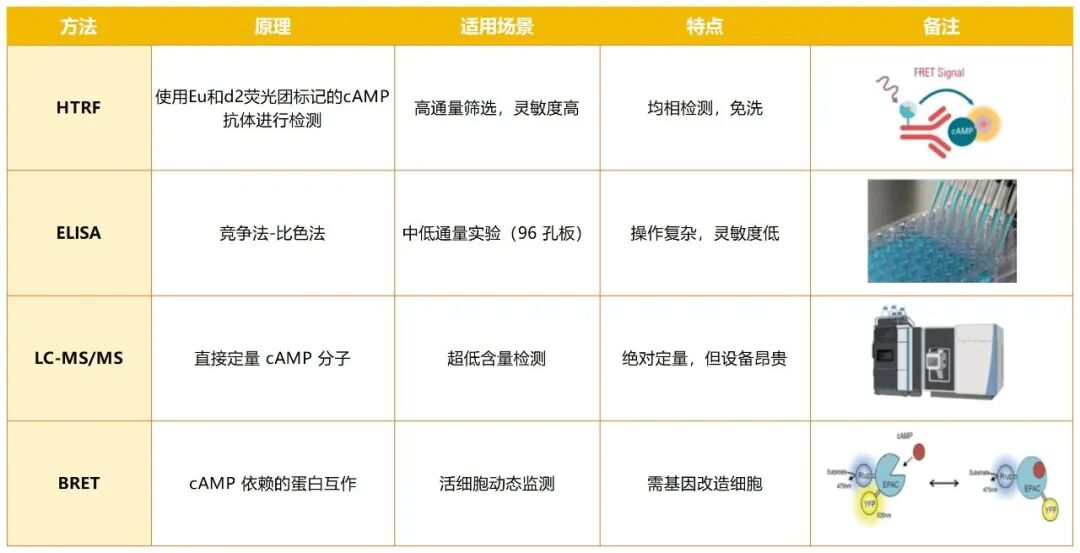
传统cAMP检测方法存在明显局限:ELISA操作繁琐需反复洗涤,LC-MS/MS设备成本高,BRET需对细胞进行基因改造,均难以满足药物研发中高通量、高灵敏的检测需求。而均相时间分辨荧光(HTRF)技术凭借独特优势,成为当前cAMP检测的优选方案,不同检测方法对比见下表:
HTRF技术基于竞争性结合原理实现 cAMP 精准定量:细胞产生的天然cAMP与d2红色染料标记的CAMP ,竞争性地与穴状化合物Eu标记的抗 cAMP抗体结合。当d2红色染料标记的cAMP与Eu标记的抗cAMP抗体结合时,体系中会产生较高的 HTRF 信号,而无标记 cAMP 与 Eu 标记的抗cAMP抗体结合,则不会产生HTRF 信号。因此,特异性HTRF信号与样品中天然cAMP的浓度成反比。细胞中普遍存在的磷酸二酯酶(PDEs)具有水解胞内cAMP的功能,为了防止PDEs作用下cAMP降解为AMP,建议实验中使用PDEs 泛抑制剂 (IBMX)以确保适当的cAMP积累及其后续检测。
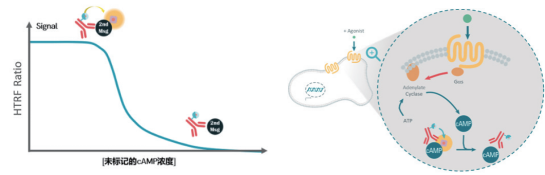
它的核心原理很巧妙,靠的是一场“竞争性结合”
1. 准备“检测搭档”:一边是用穴状化合物(Eu Cryptate)标记的“抗cAMP抗体”,另一边是用d2红色荧光染料标记的“cAMP(cAMP-d2)”。这对“搭档”一旦结合,就会通过荧光能量共振转移(FRET)产生特定的HTRF信号。
2. 细胞“释放”cAMP:当我们用药物刺激细胞后,细胞内会产生天然cAMP。把细胞裂解后,这些内源性的天然cAMP就会和“cAMP-d2”一起,竞争结合Eu标记的抗体。
3. 信号解读“浓度”:样本中天然cAMP越多,“cAMP-d2”能结合抗体的机会就越少,产生的HTRF信号就越弱;反之,天然cAMP越少,信号越强。简单说,HTRF信号和cAMP浓度成反比,通过信号强弱就能算出cAMP的准确浓度。
这里还有个小细节:细胞里有一种叫“磷酸二酯酶(PDEs)”的物质,会把cAMP分解成AMP,影响检测结果。所以实验中通常会加一种叫IBMX的“PDEs抑制剂”,相当于给cAMP“保驾护航”,确保它能稳定积累,让检测更准确。
04
选对试剂盒:不同GPCR,要“对症下药”
不是所有GPCR对cAMP的影响都一样,有的让cAMP大幅升高(比如Gαs偶联受体),有的让cAMP小幅降低(比如Gαi偶联受体)。如果用同一种试剂盒检测,很可能“捕捉不到”细微变化,或者超出检测范围。
Revvity提供了三种cAMP检测试剂盒,可更好地满足用户在定量响应不同类型 Gα亚基激活的 cAMP 积累时的需求。
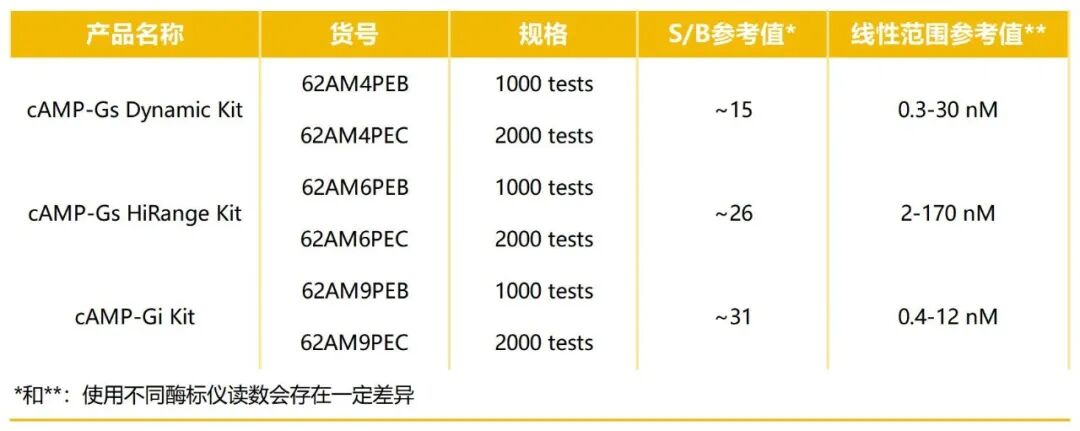
举个例子:研发治疗糖尿病的GLP-1受体激动剂时,GLP-1受体是Gαs偶联型,激活后cAMP会大幅升高,这时选“cAMP-Gs HiRange Kit”就能准确覆盖高浓度范围;而研究某些抑制性GPCR(如治疗失眠的GABA受体)时,cAMP变化幅度小,“cAMP-Gi Kit”的高灵敏度就能派上用场。
05
实验优化:这4步,让数据更可靠
有了好技术和试剂盒,实验操作的优化也很关键。分享几个核心优化步骤,帮你避开“坑”:
01
选对细胞培养方式:贴壁还是悬浮?
贴壁培养:更贴近细胞在体内的生理状态,适合研究对细胞形态敏感的受体
悬浮培养:步骤更快速灵活,适合高通量筛选。
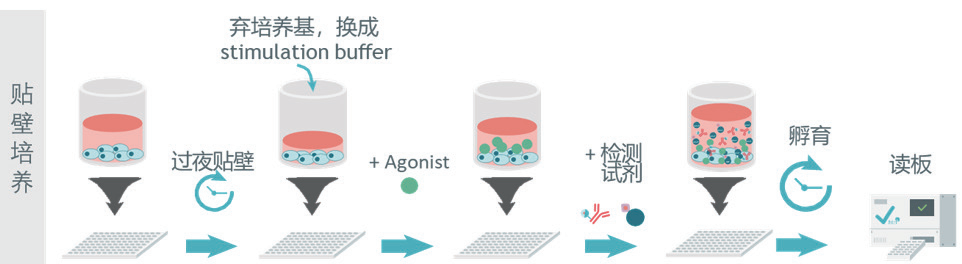
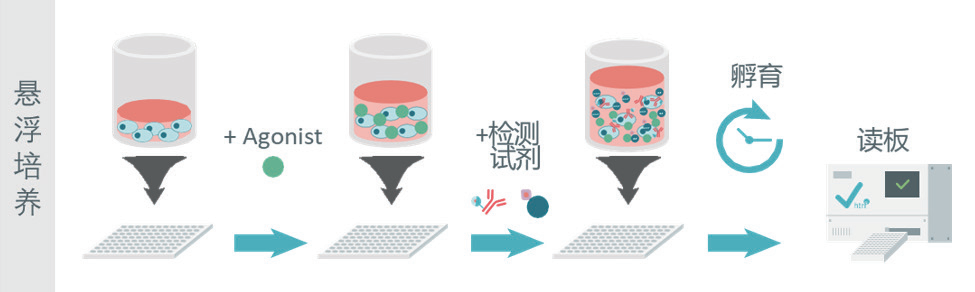
02
做准标准曲线:确定检测“黄金范围”
标准曲线是计算cAMP浓度的“标尺”,必须做好这几点:
用实验对应的刺激缓冲液稀释cAMP标准品,避免环境差异影响结果;
通过Graphpad Prism拟合曲线,找到“IC10”和“IC90”,只有样本的HTRF信号落在这两个值之间,才能准确回算cAMP浓度。
03
优化细胞密度:不多不少才刚好
细胞太少:产生的cAMP不足,信号太弱;
细胞太多:可能挤压检测窗口,导致信号饱和。
建议用完全激动剂(比如检测Gαs受体时用Forskolin)测试不同密度,找到“检测窗口最大、信号落在标准曲线范围内”的密度。
04
定好刺激时间和IBMX浓度
刺激时间:不同激动剂与受体结合的速度不同,比如异丙shen上腺素刺激β2受体时,15分钟后信号就会达到平衡,之后保持稳定,所以15-120分钟是最佳检测窗口。
IBMX浓度:一般加0.5mM就能抑制大部分PDEs活性,特殊细胞类型可适当调整。
HTRF技术,让GPCR研发更“高效精准”
凭借对 cAMP 的精准检测能力、适配不同 GPCR 的试剂盒体系及完善的实验优化方案,HTRF 技术既能快速捕捉 cAMP 细微变化,又能满足高通量筛选需求,为 GPCR 药物研发节省时间与成本。随着孤儿受体、多靶点联合等 GPCR 新靶点不断拓展,HTRF 技术的应用场景将进一步拓宽,未来有望助力更多治疗高血压、糖尿病、肥胖等疾病的 GPCR 新药研发,为临床治疗提供更多有效选择。
参考文献:
[1] Hauser AS, Attwood MM, Rask-Andersen M, Schiöth HB, Gloriam DE. Trends in GPCR drug discovery: new agents, targets and indications. Nat Rev Drug Discov. 2017 Dec;16(12):829-842. doi: 10.1038/nrd.2017.178. Epub 2017 Oct 27. PMID: 29075003; PMCID: PMC6882681.
# END #
版权声明:本文为个人整理文章,内容仅供参考,旨在促进学术交流与信息共享,如有异议或侵权,请联系我们处理。
©2022-2025 柏澳集 All Rights Reserved. 苏ICP备19039921号-2
建议您使用Chrome、Firefox、Edge、IE10及以上版本和360等主流浏览器浏览本网站。
本网站销售的所有产品均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。
互联网药品信息服务资格证书编号:苏-经营性-2022-0029 、增值电信业务经营许可证:苏B2-20221250 、医疗器械生产(经营)许可证或备案凭证编号:苏泰食药监械经营备20207022号